2024年1月10日,中国科学技术大学国家同步辐射实验室田立娇课题组在国际著名期刊ACS Nano再次发表冷冻软X射线断层成像(cryo-SXT)相关工作,基于之前“Direct Visualization and Restoration of Metallic Ion-Induced Subcellular Ultrastructural Remodeling”工作基础,将研究对象拓展至莱茵衣藻,发表创新科研成果: Near-Native Imaging of Label-Free Silver Nanoparticles-Triggered 3D Subcellular Ultrastructural Reorganization in Microalgae。该研究基于近天然3D成像方法,cryo-SXT,可视化银纳米颗粒(Cit-AgNPs)与莱茵衣藻的相互作用。Cryo-SXT展示了Cit-AgNPs的三维空间分布,位于胞外聚合物(EPS)和细胞质中。此外,Cryo-SXT揭示了Cit-AgNPs重塑藻的亚细胞结构,包含叶绿体膜破坏、蛋白核减小、淀粉鞘变薄、淀粉颗粒和脂滴极度膨胀、核仁皱缩、淀粉颗粒的数量和体积占有率增加、淀粉颗粒呈分散分布。本研究联合亚细胞结构和生理特性指标,阐明了纳米银触发的微藻生物响应机制。

【研究背景】
纳米材料已广泛应用于纳米医学、环境消毒、消费品等众多领域。其中,纳米银(AgNPs)因其优异的抗菌、抗炎特性而受到越来越多的关注。广泛使用的纳米材料对水生生物具有潜在的有害影响,并引发细胞内生物物理化学反应。微藻是水生浮游植物的模式物种,也是环境毒性的敏感指标。作为初级生产者,纳米粒子引发的藻类改变将影响水生生态系统中的营养消耗和养分循环。目前,针对浮游植物藻类的纳米毒理研究主要集中在相应的生理表型和分子机制上。然而,纳米颗粒对细胞超微结构变化的影响仍存在知识空白。
基于同步辐射的cryo-SXT是一种有前途的、无损的单细胞3D成像技术。重要的是,它可以同时收集无标记纳米颗粒的3D空间分布和3D细胞超微结构。与传统成像方法相比,cryo-SXT消除了光学成像分辨率差和电子显微镜穿透深度低的限制。具体来说,生物体通过快速冷冻无需预处理即可保持接近天然的状态。在 Cryo-SXT中,细胞区室中的图像对比度差异在于X射线光子吸收的固有变化,这可以通过线性吸收系数(LAC) 记录。结合超微结构特征和LAC值,可以轻松识别纳米粒子和细胞器。同时,生成的亚细胞3D结构可进行定量的形态学分析。
我们首先使用cryo-SXT技术直接可视化莱茵衣藻中纳米颗粒的空间位置(图1)。根据 2D断层图像,可以在细胞质以及细胞外聚合物(EPS)中观察到AgNPs(酒红色)(图1A-C 和E-F)。通过三维重构和后续分割渲染进一步直接可视化AgNPs的3D空间位置(图1D和G)。
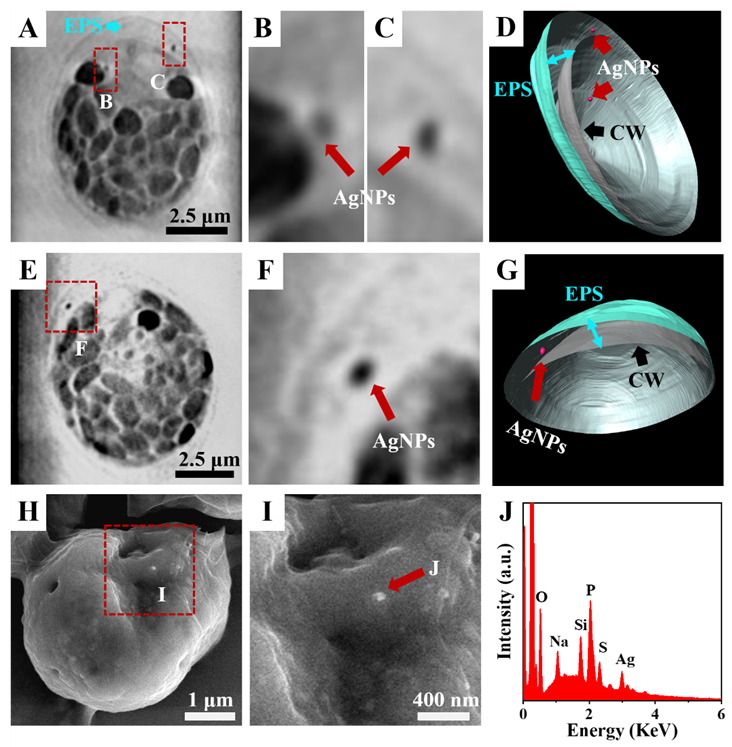
图1. Cit-AgNPs 的 3D 亚细胞分布
AgNPs重塑莱茵衣藻能量代谢相关的细胞器
在Cit-AgNPs暴露下变化最明显的细胞器是叶绿体(图3)。3D渲染和2D断层图像显示了位于正常细胞中的杯状和光滑的叶绿体(图3A)。但是,在Cit-AgNPs处理组中,不能从背景中识别叶绿体的边界(图3B),这一结果得到TEM结果和叶绿素含量降低的验证。这些结果共同表明Cit-AgNPs暴露损害藻类光合作用。淀粉鞘和类蛋白核(图4)也发生改变。通常,淀粉鞘沉积在蛋白核周围并存在于叶绿体的中心(图4A)。Cit-AgNPs处理后,淀粉鞘的厚度和体积减少(图4B)。除了形态之外,Cit-AgNPs还改变了淀粉颗粒的空间方向。在正常细胞中,淀粉颗粒存在于叶绿体基质中(图5A)。Cit-AgNPs暴露后,淀粉颗粒在细胞质中重新分布并呈现弥散分布(图5B)。

图4. AgNPs诱导淀粉鞘和蛋白核的结构变化
Cit-AgNPs导致莱茵衣藻中脂滴的膨胀(图6)。在正常生长过程中,脂滴约占每个细胞体积的 2.0%,而在暴露于Cit-AgNPs的藻类中,脂滴含量增加至3.5%。相应地,单个脂滴的平均体积从0.11 μm3增加到0.37 μm3。与之吻合,与Cit-AgNPs共孵育的莱茵衣藻显示出比对照组强5.8倍的脂质过氧化(LPO)信号。因此,Cit-AgNPs增强了LPO,并提高了莱茵衣藻中脂质体的体积比例。Cit-AgNPs也减少了核仁的体积,将其从0.46 μm3减少到0.28 μm3。与此同时,相应的体积占有率从0.60%下降至0.23%。
纳米银触发的微藻生物响应机制
基于细胞器和表型上响应特征,我们推断出暴露于Cit-AgNPs的莱茵衣藻的细胞毒性反应途径(图 7)。微藻与AgNPs接触后,部分纳米颗粒会沉淀在 EPS中。这样的定位减少了Cit-AgNPs和细胞壁之间的直接物理接触,保护细胞免受纳米效应的影响。与此同时,一些Cit-AgNPs被降解为游离的Ag+,随后被莱茵衣藻摄入。摄入的Ag+可部分还原并在细胞质中结晶。此外,内化的Ag+倾向于与叶绿体和线粒体相互作用,然后促进ROS的产生。ROS增加会引起脂质过氧化 (LPO),导致脂肪酸过载。过量的游离脂肪酸会对这些细胞器造成结构损伤,表现为叶绿体和线粒体膜的完整性受损。Cit-AgNPs破坏叶绿体和线粒体的结构完整性,中断光反应和氧化磷酸化的能量转导,从而损害藻类的光合作用,导致ATP 生成紊乱。较低的能量供应会抑制碳固定,导致蛋白核和淀粉鞘显著衰减,淀粉颗粒极度膨胀。线粒体中超载的脂肪酸可以通过膜接触位点输送到脂滴中,导致脂滴膨胀。同时,产生的ROS还可以进入细胞质,产生氧化应激损伤。

图7. 纳米银触发的微藻生物响应机制
【结论】
总之,这项工作基于cryo-SXT成像探究纳米颗粒与生物体之间相互作用。Cryo-SXT有强大的成像能力,可用于生物纳米相互作用和毒性评估的定性和定量分析,从而能够以高分辨率同时对未标记的纳米颗粒和3D超微结构进行成像。
中国科学技术大学国家同步辐射实验室田立娇副研究员为本论文的通讯作者,博士研究生徐帅和陶夏禹为本论文的共同第一作者。本研究受到国家自然科学基金, 安徽省自然科学基金等项目资助。
田立娇团队研究方向:基于同步辐射探究有机生命与无机物质的互作研究,包括活体材料的可控构筑(J. Am. Chem. Soc. 2017, 139, 35, 12149–12152;Environ. Sci. Technol. 2020, 54, 17, 10713–10721)和应用(J. Am. Chem. Soc. 2022, 144, 14, 6434–6441)、生物多级有序组装纳米颗粒机制(ACS Nano 2019, 13, 5, 5841–5851;ACS Nano 2023, 17, 10, 9069–9081)和纳米材料的生物效应。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c08514


